水稻
水稻生育期长短对最终产量形成有着极其重要的影响。因此, 发掘并利用控制水稻生育期相关基因的新等位变异, 对于培育高产广适性水稻新品种具有重要实用价值。水稻抽穗期和产量性状都属数量性状, 并对环境变化极为敏感[1]; 因此有很多已定位的QTL区间往往对这两类性状具有多效性, 产量的提高往往伴随着抽穗期的延迟。控制抽穗期相关基因的等位变异一般都与品种的地域和季节适应性相关, 因此在育种实践中育种家往往倾向于筛选适合特定生态区域的品种[2,3,4]。
环境条件和植物自身调节机制都会影响水稻抽穗期, 而在这些因素中光周期是最重要的开花诱导影响因子[5]。不同类型的品种会表现出不同的遗传特性, 而同一品种的抽穗期也会由于不同光温条件的影响而表现各异。我国水稻主要栽培品种的抽穗期与其感光性、基本营养生长习性有着显著线性关 系[4]。水稻抽穗期遗传机制复杂, 根据对Gramene网站QTL数据库(http://www.gramene.org/qtl/index.html)
的分析, 显示有超过700个涉及生育期的QTL, 分布于水稻所有12条染色体上。目前以 Hd3a、 Hd1、 Ehd1、 Ghd7和 Ghd8等为代表的控制水稻抽穗期的重要基因位点都已相继被克隆[6,7,8,9,10,11,12,13,14,15]。拟南芥中与抽穗开花相关的基因, 一般在水稻中都能找到与之同源的基因, 并且有着相似的功能。因此, 得益于拟南芥开花调控机制的研究, 有关光周期控制水稻开花的调控网络也有了较好的阐述[16,17]。
拟南芥 ELF3被证明是控制光信号输入生物节律钟的重要基因, 在长日照条件下可促进拟南芥开花[16]。在水稻中, 位于第1染色体上的 OsELF3基因与拟南芥 ELF3基因高度同源, 其T-DNA插入突变体 osef3在长日照和短日照条件下都表现出延迟抽穗, 同时还具有多效性[18]。最近, 在水稻第6染色体上定位的 ELF3的同源基因 Ef7, 也是控制抽穗期的关键基因[19], 其通过调节植株昼夜节律、下调开花抑制因子 Ghd7的表达来促进水稻抽穗开花[20,21,22,23]。研究表明, Ef7不同的等位变异形式在不同光照条件下的抽穗期表现会有所不同[20,21,22,23]。其中 ef7突变体HS276在长日照和短日照下均能延迟抽穗, T-DNA插入突变体 oself3-1在长短日照条件下均不同程度延迟抽穗; 但是, 含有越光 Ef7等位基因 Hd17的近等基因系只在长日照下延迟抽穗, Tos17突变体 oself3也只在长日照下延迟抽穗, 短日照下抽穗期和野生型相比无明显差异。
本研究根据已克隆的日本晴 Ef7基因序列, 从我国籼稻杂交稻重要亲本龙特甫中克隆了该基因的等位基因, 命名为 Ef7-l。在此基础上, 以日本晴为轮回亲本构建了 Ef7-l的近等基因系, 分析了 Ef7-l控制的抽穗期和产量性状的表现。
选用粳稻品种日本晴( Oryza sativaL. subsp. japonica cv. Nipponbare)和籼稻品种龙特甫( Oryza sativa L. subsp. indicacv. Longtefu); 以及分别以这2个品种为轮回亲本和供体亲本来源的一个高世 代(BC4F2)的回交系CL42。以日本晴为轮回亲本, 继续和CL42回交2次, 并自交3代, 经分子标记 辅助选择, 在BC6F3世代中选育获得含有来源于龙特甫第6染色体短臂 Ef7基因区段的近等基因系CL63。
按CTAB法[24]从水稻叶片中提取基因组DNA, 用于PCR反应。20 µL的PCR反应体系包括1 µg的模板DNA、0.5 µL (10 mmol L-1)引物、0.4 µL (10 mmol L-1) dNTP、2 µL 10×PCR缓冲液、1 U rTaqDNA聚合酶和15.5 µL超纯水。在Biometra PCR仪上进行PCR扩增, 反应条件为: 95°C预变性4 min; 94°C下30 s, 55°C下30 s, 72°C下40 s, 共35个循环; 72°C下延伸5 min。反应产物经3%琼脂糖凝胶电泳, 溴化乙锭染色后在凝胶成像仪上成像, 分析检测样品间的多态性。
使用高保真DNA聚合酶 pfu (Ferments) 从水稻基因组DNA中扩增目的基因片段, 所用引物是针对 Ef7 (LOC_Os06g05060) 基因设计的特异性引物Ef7-gDNA (表1)。按产品推荐的程序进行PCR反应, 将扩增产物送南京金斯瑞生物科技有限公司测序。在NCBI网站(http://www.ncbi.nlm.nih.gov/)上查找相关基因的核酸序列, 在水稻全基因组信息数据库(http://rice.plantbiology.msu.edu/)上查询基因功能基本注释, 在Gramene网站(http://www.gramene.org/)上查询基于日本晴的水稻序列信息, 在UniProt网站(http://www.uniprot.org/)上分析蛋白质基本信息, 利用软件DNAstar和Vector NTI 9.0分析一些核苷酸和氨基酸序列。
| 表1 本研究中使用的引物 Table 1 Primers used in this study |
2011年夏季和冬季分别在江苏省扬州大学校内试验基地和海南陵水南繁基地种植近等基因系CL63及其受体日本晴, 上述2个种植环境分别具自然长日照和短日照条件。种植每个材料3个重复, 每个重复40苗, 调查性状时取每个重复中间20苗。此外, 还于2011年夏季在扬州大学校内试验基地设置短和长日照两个光周期处理, 其中短日照处理为光照8 h/黑暗16 h, 长日照处理为自然光照14 h/黑暗10 h, 每个材料3个重复, 每个重复20苗, 选取每个重复中间10苗用于调查抽穗期。
自开始抽穗后每2 d调查一次抽穗情况, 以一个植株第1穗抽出1 cm当日计为该株的抽穗日, 以播种日到抽穗日的天数计为抽穗期。成熟期考察CL63和日本晴的主要农艺性状, 包括株高、主穗长、每株穗数、每穗粒数、结实率、千粒重。使用SPSS 16.0软件对所有数据进行独立样本 t测验, 以分析相关数值在日本晴和CL63之间的差异显著性, 数据以平均数±标准差(mean ± SD)的形式表示。
使用RNA提取试剂盒(北京天根生化科技有限公司)提取水稻幼苗总RNA。使用变性琼脂糖凝胶电泳和NanoDrop仪(Thermo)检测RNA的质量, DNaseI酶消化总RNA, 利用反转录试剂盒(Fermentas)获得cDNA。以cDNA为模板扩增水稻内参基因 Actin (LOC_Os03g0718100), 调节cDNA的模板浓度趋于一致。用于 Ef7基因和 Actin基因表达量分析的引物分别为Ef7-RT和Actin-RT (表1)。在ABI公司的ABI 7500仪器上进行荧光定量PCR, 按照SYBR Green qRT-PCR方法推荐的25 µL反应体系; PCR扩增条件为94℃预变性3 min; 94℃变性15 s, 55℃退火15 s, 72℃延伸35 s, 循环数40。以溶解曲线分析确定扩增产物的特异性, 使用相对定量的方法分析实验结果[25]。
为了深入分析我国栽培水稻中 Ef7基因不同等位变异的效应, 根据日本晴 Ef7基因序列, 采用同源克隆技术, 从我国籼型杂交稻一个重要亲本龙特甫中克隆了该基因的等位基因 Ef7-l, 并测定了其全序列(GenBank登录号为KC204687)。克隆的 Ef7-l序列全长5134 bp, 其中包括全部编码区序列和部分上下游序列。将 Ef7-l与已发表的日本晴 Ef7基因序列(LOC_Os06g05060)比对, 发现两者在内含子序列上存在6处差异, 但这些差异都远离内含子与外显子剪接位点处; 而在外显子序列上有6个单核苷酸变异(SNP), 涉及5个位置的氨基酸残基的变化, 分别由日本晴的氨基酸残基P (脯氨酸)、S (丝氨酸)、L (亮氨酸)、V (缬氨酸)和S (丝氨酸)变为龙特甫中L (亮氨酸)、G (甘氨酸)、S (丝氨酸)、A (丙氨酸)和G (甘氨酸)(图1-c)。另一个SNP由于密码子简并性未产生氨基酸残基的变化, 位于氨基酸序列的第8位。
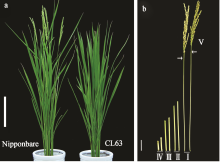
为进一步了解龙特甫中 Ef7-l等位变异是否可产生不同的遗传效应, 构建了该基因的近等基因系。本实验室在前期研究中, 以日本晴为轮回亲本、不同籼稻品种为供体亲本, 构建了一系列高世代回交材料。利用与 Ef7基因紧密相邻的一个InDel标记(INDEL7, 表1)作为辅助选择手段, 从以龙特甫为供体的高世代(BC4F2)回交材料中筛选获得了一个系CL42, 该系含有来源于龙特甫的 Ef7-l基因区段。继续以日本晴为轮回亲本与CL42回交2次、自交3次, 经分子标记辅助选择, 在BC6F3世代中选育获得只含有来源于龙特甫 Ef7基因区段的近等基因系CL63 (图1-a, b)。
为检测CL63近等基因系的背景, 利用均匀分布于水稻12条染色体上的140对分子标记[26]检测。表明 CL63近等基因系中除 Ef7区域附近的5对标记(Chr608、Chr601、INDEL7、RM587和INDEL3; 图1-b)与供体亲本龙特甫相同外, 其余分子标记的带型均与日本晴相同。并且CL63系中目标基因区段之外的附近已克隆的抽穗期相关基因 Hd3a、 RFT1、 Hd1都已回复为日本晴的基因型(图1-b)。据此推测,近等基因系CL63中只含有一个来源于龙特甫的导入片段, 区间为Chr608-INDEL7-INDEL3 (图1-b), 在此导入片段区间只含有一个抽穗期相关基因 Ef7, 覆盖的物理距离大约为636 kb (表1)。
将近等基因系CL63与日本晴杂交获得杂种F1代, 在扬州正季自然长日照条件下同时种植日本晴、CL63及其F1杂种, CL63抽穗期比轮回亲本日本晴延迟约6 d (图2-a和表2), 而F1植株的抽穗期与日本晴一致。说明近等基因系CL63迟抽穗表型
属隐性遗传。在海南陵水冬季自然短日照条件下, CL63与日本晴两者抽穗期无显著差异, 都约为68 d (表2)。2011年在扬州夏季条件下, 保持相同的温度条件, 进行不同时间长度的光照处理后比较CL63和日本晴的抽穗期。在长光照处理下, CL63的抽穗天数约为85 d, 而轮回亲本日本晴的抽穗天数约为79 d, CL63比轮回亲本延迟抽穗约6 d。在短光照条件下, 两者抽穗期无显著差异, 但其抽穗期相对于长光照处理条件均明显提前, 都为54 d左右(表3)。
| 表2 日本晴和CL63的主要农艺性状比较 Table 2 Comparison of the main agronomic traits between Nipponbare and CL63 (mean± SD, n=20) |
| 表3 日本晴和CL63在不同光照时间处理下的抽穗期 Table 3 Heading date of Nipponbare and CL63 under different light conditions (mean± SD, n=10) |
**代表在 P<0.01水平上差异显著。
** represents the significant differences at P<0.01.
扬州正季自然光温条件下, 成熟期CL63的各个节间长度相对于日本晴均有所增长, 导致它的株高与野生型日本晴相比有显著升高(图2); 同时发现CL63的茎秆相对于日本晴略粗, 预示其抗倒伏能力可能有所增强。与日本晴相比, CL63粒重显著增加, 但其他主要性状并没有显著变化(表2)。在海南冬季短日照自然条件下, 由于CL63与日本晴的抽穗期没有差异, 两者的主要农艺性状也没有显著不同(表2)。
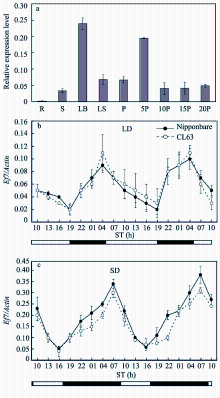
为了解 Ef7基因的表达特性, 首先选取日本晴不同器官, 提取总RNA进行实时定量RT-PCR分析(图3-a), 这些器官包括: (1)根; (2)茎秆; (3)叶片; (4)叶鞘; (5)抽穗前的幼穗; (6)开花后5 d的幼穗; (7)开花后10 d的穗; (8)开花后15 d的穗; (9)开花后20 d的穗。结果表明, Ef7在日本晴叶片中的表达量显著高于其他组织(图3-a), 表明该基因可能类似于其在拟南芥中的同源基因 ELF3中的表达模式和作用机制, 在水稻中同样参与了光调控作用。在上述研究的基础上, 重点以不同光照条件下生长的CL63和日本晴幼苗期叶片为材料, 在48 h时间节律周期内每隔3 h取样用于提取总RNA进行RT-PCR分析, 进一步分析 Ef7-l等位基因随时间节律的表达特性(图3-b, c)。结果表明, 无论在长光照条件下还是在短光照条件下, 相对于CL63中的 Ef7-l等位基因随昼夜振荡的表达规律与日本晴中的 Ef7基因基本一致(图3-b, c), 说明 Ef7-l等位变异并没有影响基因的转录。
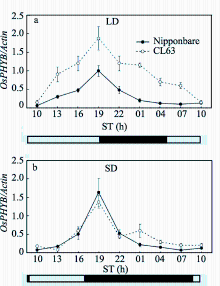
已有研究表明, 拟南芥中ELF3在植株生长前期通过参与结合PHYB来介导光信号的输入, 从而调节开花时间[27]。在水稻中, Ef7基因可通过下调开花抑制因子 Ghd7的表达来促进开花[20,21,22,23], 而 Ghd7的转录也可受 OsPHYB基因(Os03g19590)的调 控[12]。为进一步了解 Ef7是否通过调节 OsPHYB基因来抑制 Ghd7的转录水平, 我们比较了CL63和日本晴中 OsPHYB的表达特性(图4)。结果显示, 在长光照条件下日本晴中 OsPHYB表达水平显著低于CL63中(图4-a), 而在短光照条件下2份水稻材料中 OsPHYB的表达水平并无显著差异(图4-b)。
近等基因系因其遗传背景与轮回亲本较为一致, 因此是准确鉴定等位基因遗传效应的最好材料; 此外, 具有良好表型的近等基因系还可以直接应用于品种改良。Matsubara等[23]以越光为供体亲本和日本晴为受体亲本构建近等基因系, 克隆了一个抽穗期基因 Hd17, 证明是 Ef7的等位基因。 Hd17与日本晴 Ef7基因相比, 仅在氨基酸序列第558位处的亮氨酸突变为丝氨酸[23]。本研究从我国籼稻品种龙特甫中克隆鉴定了 Ef7的等位基因 Ef7-l, 与 Hd17相比, Ef7-l编码区有5个序列变异, 导致4个氨基酸残基变化(图1-c)。可见, 本研究所克隆的 Ef7的等位基因 Ef7-l可能是一个新的等位变异类型。我们初步的研究表明, 在我国许多籼稻品种中的 Ef7基因都 与 Ef7-l相似, 预示该基因在不同地域产生了明显的分化。
我们以龙特甫为供体和日本晴为受体构建了 Ef7-l的近等基因系CL63。CL63在长光照条件下能够延迟抽穗, 而在短光照条件下抽穗期与受体亲本无显著差异。同样以日本晴为受体, 越光为供体构建的 Hd17近等基因系, 在短日照下的抽穗期与受体亲本相同, 而在长日照条件下 Hd17对抽穗期有明显的延迟效应[23]。由此说明, 虽然 Ef7-l和 Hd17在序列上存在较多的差异, 但是两者对于抽穗期的效应较为相似。
水稻抽穗期长短和产量密切相关, 具有较迟抽穗期的品种往往能产生更多的生物产量[28]。而控制抽穗期的基因往往具有多效性, 目前至少有2个具有一因多效的抽穗期基因已被克隆, 即 Ghd7和 Ghd8 ( DTH8)[11,13,14,15], 这2个基因对抽穗期和产量性状兼具主效作用。本研究克隆的 Ef7-l等位基因在长日照条件下可延迟抽穗, 含该位基因的近等基因系植株的各节间长度与受体亲本相比有所增加, 茎秆直径变粗, 株高和千粒重有显著增加, 具有显著的增产潜力。一般高纬度地区的日照时间往往较长, 因此该等位基因可能在高纬度地区有重要的实际应用价值。
野生型 Ef7基因在叶片中表达量最高, 且在不同光照条件下 Ef7-l的表达量与野生型 Ef7基因无显著差异; 但是在长光照下 Ef7-l基因能够上调 OsPHYB的转录水平。由此推测, 在长光照条件下CL63中的 Ef7-l等位变异可能导致 OsPHYB转录水平上调, 从而延迟抽穗期; 而在短光照条件下 Ef7-l等位变异对 OsPHYB的转录并无明显影响, 因此对抽穗期也没有影响。但是有关该等位基因延迟抽穗的机制还有待更深入的研究。
本研究从籼稻品种龙特甫中克隆了一个 Ef7基因的新等位基因 Ef7-l, 并构建了近等基因系CL63。CL63在长光照条件下能够延迟抽穗, 而在短光照条件下抽穗期无显著变化。长日照下CL63的各节间长度, 与受体亲本相比均有所增加, 茎秆直径变粗, 株高和千粒重显著增加。 Ef7-l在叶片中表达量最高, 且在不同光照条件下 Ef7-l的表达量与野生型 Ef7基因无显著差异; 在长光照下 Ef7-l基因能够上调 OsPHYB的转录水平。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|